近日,东南大学生物科学与医学工程学院、生物电子学国家重点实验室的吴富根教授课题组在通过纳米药物诱导肿瘤内原位生成肿瘤疫苗以实现癌症免疫治疗的研究中取得重要进展,相关成果以“In situ generation of micrometer-sized tumor cell-derived vesicles as autologous cancer vaccines for boosting systemic immune responses”为题在《Nature Communications》上在线发表。
近年来,癌症免疫治疗在癌症治疗中显示出巨大的前景。各种癌症免疫治疗方法,如免疫检查点阻断疗法、肿瘤疫苗和嵌合抗原受体T细胞(CAR-T)治疗,已被广泛研究并取得了一定的成果。其中,肿瘤疫苗能够激发肿瘤特异性免疫,是最重要的免疫治疗策略之一,在癌症治疗中具有巨大的潜力。然而,肿瘤疫苗的临床应用仍停留在癌症预防阶段。如何在癌症患者中引发大量的抗肿瘤免疫反应仍然是一个巨大的挑战。主要原因是这些肿瘤疫苗的免疫原性较弱,免疫抑制性肿瘤微环境和肿瘤疫苗中的抗原与特定患者的肿瘤之间的低相关性等问题。
癌症患者自身肿瘤具有丰富的肿瘤相关抗原,因此利用患者自身肿瘤组织可以构建出比传统癌症疫苗具有更强机体免疫反应诱导能力的新型个性化癌症疫苗,并实现“取之于病人、用之于病人”的疫苗制备和应用策略。不过,体外制备自身肿瘤来源的癌症疫苗存在很多技术困难,如制备步骤繁琐、容易发生生物污染、产率很低、且病灶区靶向效果及最终疗效不佳等问题。因此,如何有效地在癌症患者体内(肿瘤区域)大规模原位生成自身肿瘤来源的癌症疫苗,以避免上述提及的体外肿瘤疫苗的各种缺点,具有重要的临床应用意义。
吴富根教授课题组将阿霉素和酪氨酸激酶抑制剂共同负载在树枝状高分子的疏水内核,并在外部包裹透明质酸,制备出了一系列纳米药物(即HDDT纳米颗粒)。实验发现,该HDDT纳米药物可以发挥类似“纳米炸弹”的作用,能将各种癌细胞(大小为10-30微米)裂解为微米大小的细胞囊泡(1.6−3.2 μm),且具有约100%的细胞至微米囊泡的转化效率。通过蛋白组学和体外免疫细胞的激活等相关表征证明了所产生的微米囊泡具有很强的免疫刺激作用,并可以用作肿瘤疫苗。尾静脉注射该“纳米炸弹”之后,可以在肿瘤组织中大量原位生成携带有肿瘤相关抗原和危险因子的微米囊泡,并将肿瘤组织原位转化为疫苗库,从而引发机体全身性的抗肿瘤免疫反应,实现癌症的免疫治疗。
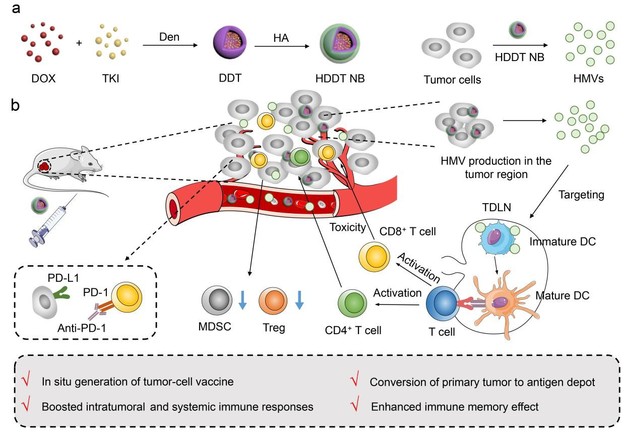
HDDT纳米炸弹的合成和原位生成肿瘤自体疫苗用于肿瘤免疫治疗的示意图(图片来自Nature Communications)
进一步,作者在两种荷瘤小鼠模型中证实了该HDDT纳米炸弹可以抑制肿瘤生长并诱导肿瘤细胞发生免疫原性细胞死亡及机体的全身性抗肿瘤免疫反应。此外,由HDDT纳米炸弹治愈的小鼠可展现出强烈的免疫记忆效应,从而实现对肿瘤复发的抑制和对机体的长期抗癌防护。
总之,该工作创新性地合成了一种可以使肿瘤细胞裂解并大量生成微米囊泡的纳米药物,为制备含肿瘤相关抗原的微囊泡和开发个性化癌症疫苗提供了新的策略。
本工作的第一作者为东南大学生物科学与医学工程学院的博士生郭育新,通讯作者为吴富根教授(课题组网站:https://www.x-mol.com/groups/wu_fugen),东南大学为该工作的唯一完成单位。该工作得到了江苏省自然科学基金和国家自然科学基金等资助。
论文链接:https://www.nature.com/articles/s41467-022-33831-7




