2025年3月10日,国际著名学术期刊《Biomaterials》在线发表了东南大学数字医学工程全国重点实验室梁高林教授、王睿研究员团队的最新研究成果,文章题目为《Acid and phosphatase-triggered release and trapping of a prodrug on cancer cell enhance its chemotherapy》。该研究提出了一种“释放与捕获”新型药物递送策略,可以将化疗药物“锁定”在肿瘤部位,使其长时间发挥作用。该策略在小鼠乳腺癌模型中显著提升了化疗效果(Biomaterials 2025, DOI: 10.1016/j.biomaterials.2025.123254)。
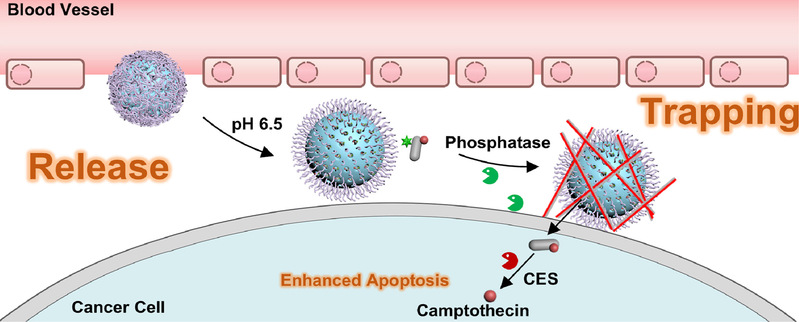
化疗是常见的癌症治疗手段,但传统的小分子化疗药物缺乏对肿瘤的靶向性,往往在全身扩散,杀死癌细胞的同时也伤害健康细胞,副作用严重。近年来,研究人员开发了许多基于纳米载体的药物递送系统,希望将化疗药物更精准地递送至肿瘤病灶。然而,这些纳米载体常常因无法与肿瘤细胞有效结合而从肿瘤组织中“漏走”,导致药物在肿瘤部位的实际滞留时间很短,靶向效率不理想。如何让运送到肿瘤病灶的药物“留得住、作用久”一直是纳米医学领域的一大挑战。针对这一难题,梁高林教授团队设计出一种对肿瘤微环境和酶双重响应的纳米药物Nap-FYp-CPT@MSN-CHI。该系统由两部分组成:包含化疗药物喜树碱(CPT)的多肽前药Nap-FYp-CPT,以及介孔二氧化硅纳米载体MSN-CHI。研究人员巧妙地利用肿瘤独特的生理环境来实现“释放与捕获”:当这种纳米药物经尾静脉注射进入体内后,会通过血液循环富集到肿瘤部位。首先,肿瘤微酸性的环境触发纳米载体释放出前药分子 Nap-FYp-CPT。随后,在肿瘤细胞膜表面高表达的碱性磷酸酶(ALP)的作用下,这些释放的前药迅速发生酶触发的自组装,在细胞膜上原位形成水凝胶,犹如给肿瘤细胞表面涂上一层“黏胶”。这一水凝胶网络将附近的纳米载体牢牢“捕获”在癌细胞膜上,不让它们再逃离肿瘤组织。接下来,剩余的前药分子会缓慢地从纳米载体中持续释放,并逐渐进入癌细胞内部。在细胞内,前药又在细胞内羧酸酯酶的作用下分解释放出活性化疗药物喜树碱(见下图)。细胞和动物实验表明,纳米药物Nap-FYp-CPT@MSN-CHI可以有效靶向病灶部位并长时间滞留,显著提高了化疗药物对肿瘤的治疗效果。这种新型的药物递送策略有望应用于临床肿瘤治疗。
该论文的第一作者为东南大学数字医学工程全国重点实验室博士生朱亮熹。东南大学数字医学工程全国重点实验室王睿研究员和东南大学首席教授、数字医学工程全国重点实验室副主任梁高林为该论文的共同通讯作者。该工作在国家自然科学基金重点项目、国家自然科学基金面上项目、国家自然科学基金青年项目、江苏省前沿引领技术基础研究重大项目和东南大学博士研究生创新能力提升计划的资助下完成。
原文链接:https://www.sciencedirect.com/science/article/pii/S0142961225001735




